Pancreatite Aguda na infância
Prof. Dr Ulysses Fagundes Neto
Introdução
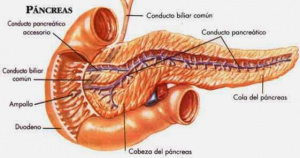
O diagnóstico da Pancreatite Aguda (PA) na infância tem aumentado de forma significativa nas últimas décadas. Uma grande diversidade de etiologias pode estar envolvida na PA, incluindo predisposições estruturais/anatômicas, obstrução biliar, trauma, infecções, toxinas, metabólicas, enfermidades sistêmicas, erros inatos do metabolismo e anomalias genéticas (Figuras 1-2).
Os objetivos desta revisão consistem principalmente em relatar as evidências publicadas no manejo da PA em crianças e fornecer recomendações para uma abordagem unificada como guia de conduta no manejo clínico desta enfermidade.
Diagnóstico e avaliação inicial da PA
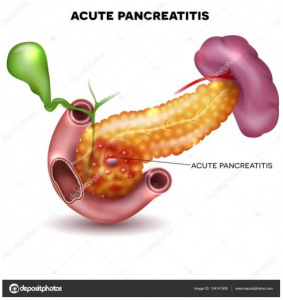
Estudos recentes estimam que a incidência da PA alcança aproximadamente 1/10mil crianças por ano. O diagnóstico da PA requer a ocorrência de pelo menos duas características clínicas, a saber: 1) dor abdominal compatível com PA; 2) níveis séricos de amilase ou lipase 3 ou mais vezes superiores aos limites normais; 3) achados de imagem consistentes com PA. Os critérios diagnósticos não especificam as fases da PA, precoce ou tardia, ou seus diversos tipos, tais como, intersticial edematosa, necrotizante, necrose infectada, ou sua gravidade (leve, moderada ou intensa), associada a falência multi-sistêmica do órgão (Figuras 3-4-5).
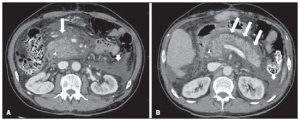
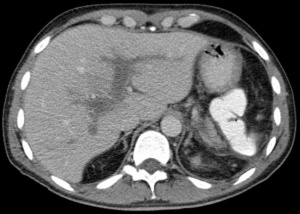
Figura 3 – Pancreatite aguda edematosa. A,B: Imagens axiais de TC pós-contraste fase venosa mostram aumento pancreático difuso, densificação dos planos adiposos peripancreáticos (setas longas) e acúmulos líquidos agudos no espaço pararrenal anterior esquerdo e na goteira paracólica esquerda (setas curtas), sem áreas de necrose parenquimatosa.
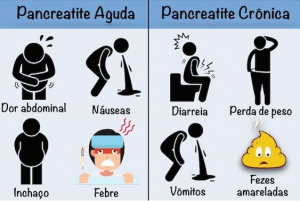
O diagnóstico da PA é clinicamente suspeitado devido à presença de sintomas compatíveis, e confirmado por testes laboratoriais e/ou de imagens. Dor abdominal e/ou irritabilidade são os achados mais comuns na PA, seguidos por dor epigástrica, náusea e vômitos. Nos lactentes e pré-escolares os sintomas podem ser sutis, e, portanto, o diagnóstico requer um alto nível de suspeição (Figura 6).
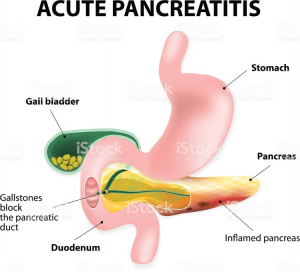
Fatores biliares obstrutivos, medicamentos e enfermidades sistêmicas são as principais causas de PA, e o conhecimento dessas possíveis etiologias servirão para guiar as investigações iniciais (Figura 7).
Biomarcadores Sorológicos
Os principais marcadores bioquímicos utilizados para o diagnóstico da PA incluem a lipase e a amilase séricas. A presença de níveis séricos da lipase ou amilase de pelo menos três vezes o limite superior da normalidade é considerado consistente com pancreatite. A lipase é secretada primariamente pelo pâncreas, embora outras fontes de lipase incluem a gástrica e a lingual. Na PA a lipase encontra-se usualmente elevada nas primeiras 6 horas dos sintomas, e, os níveis séricos atingem um pico máximo entre 24 e 30 horas, podendo permanecer elevados por mais de uma semana. Alguns autores advogam que a lipase sérica mesmo na ausência da amilase sérica é suficiente para o diagnóstico da PA, posto que, a lipase é um marcador mais sensível e específico. Além disso, a lipase sérica permanece elevada por mais tempo do que a amilase, a qual é mais útil nos casos de apresentação tardia. A amilase é secretada por vários órgãos, principalmente pelas glândulas salivares e pelo pâncreas. Os níveis séricos da amilase se elevam mais rapidamente do que os níveis séricos da lipase, e, geralmente podem se normalizar em até 24 horas após o início dos sintomas, o que a torna um fator limitante para o diagnóstico da PA nos pacientes que têm uma apresentação retardada da enfermidade.
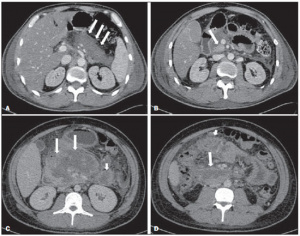
Figura 4 – Pancreatite aguda necrosante. A,B: Imagens axiais de TC pós-contraste fase venosa. Hipocontrastação difusa do colo, corpo e cauda pancreáticos (setas em A), compatível com extensa área de necrose, identificando-se pequena área de parênquima preservado no processo uncinado (seta em B). C,D: Imagens axiais de TC pós-contraste fase venosa. Pancreatite aguda necrosante em mulher de 35 anos. Extensas áreas de necrose parenquimatosa pancreática (setas longas), associadas a áreas de esteatonecrose no espaço pararrenal anterior esquerdo e no mesocólon transverso (setas curtas).
É importante enfatizar que várias condições clínicas não pancreáticas também podem causar elevações dos níveis séricos da amilase e/ou da lipase, incluindo a insuficiência hepática descompensada, insuficiência renal, inflamação intestinal (incluindo Doença Celíaca e Doença Inflamatória) trauma abdominal, cetoacidose diabética e trauma craniano.
Diversos testes laboratoriais são úteis na monitoração do curso da PA, tais como: eletrólitos séricos, ureia, creatinina e hemograma, que são importantes para monitorar o estado de hidratação e a função renal. A investigação da função hepática está indicada para se pesquisar a existência de litíase biliar e avaliar o envolvimento do fígado. Níveis séricos do cálcio e dos triglicérides também devem ser levados em consideração na investigação inicial. A monitoração do estado respiratório pode alertar o clínico a respeito da progressão da PA de leve para moderada e de moderada para grave.
Etiologias
Conforme previamente mencionado as seguintes etiologias de PA têm sido descritas: anatômicas, obstrutivas incluindo as biliares, infecciosas, traumas, tóxicos, metabólicas, sistêmica, erros inatos do metabolismo, predisposições genéticas e idiopáticas. A revisão de Lowe e cols., sumariza as seis mais importantes categorias etiológicas, a saber: idiopática/outras: 24%, trauma 17%, enfermidade sistêmica 15%, anormalidades estruturais 14%, drogas 10% e infecções 8%.
Exames de Imagens
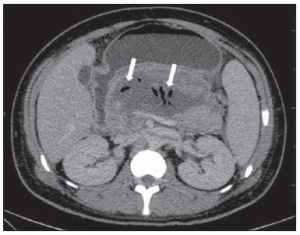
Figura 5 – Pancreatite aguda necrosante infectada. Imagem axial de TC pós-contraste fase venosa mostra área liquefeita no corpo pancreático, compatível com área de necrose, com gás em seu interior (setas) que não delineia nível hidroaéreo, mas se localiza em meio ao líquido, indicando a presença de conteúdo líquido espesso/pus. O gás neste contexto traduz a presença de infecção.
Estudos de imagens tornam-se relevantes para documentar a necrose pancreática, complicações da pancreatite incluindo coleções fluidas, e a etiologia da pancreatite, tais como, litíase biliar e anormalidades anatômicas. O critério padrão para o diagnóstico de imagem permanece sendo a tomografia computadorizada com contraste, e o contraste intravenoso é estratégico para a distinção de áreas de necrose do pâncreas. Considerando-se que estudos de imagem muito precoce podem subestimar a extensão da doença, mesmo porque as complicações se desenvolvem com o passar do tempo, os achados patológicos podem não estar presentes nas fases iniciais da enfermidade. O estudo da tomografia deve ser idealmente realizado após 96 horas do início dos sintomas. Nos casos leves a tomografia pode mostrar um aumento homogêneo do órgão, alterações inflamatórias da gordura peripancreática ou a presença de fluido circundando o pâncreas. Nos casos graves a tomografia pode mostrar aumento heterogêneo do órgão, necrose no interior do pâncreas ou circundando o tecido peripancreático. Além disso a tomografia também pode identificar coleções de fluido ou pseudos cistos (Figura 8).
A ultrassonografia é usada extensivamente quando se suspeita fortemente de pancreatite biliar, cuja situação necessita intervenção terapêutica precoce. A ultrassonografia apresenta excelente perfil de segurança, posto que, não é invasiva e não utiliza radiação. A utilidade da ultrassonografia pode, entretanto, estar limitada na avaliação do pâncreas devido a interferência de outras estruturas, tais como, gás no interior do intestino e obesidade, e, além disso, apresenta uma baixa sensibilidade em comparação com a tomografia.
A ressonância nuclear magnética não é classicamente utilizada como uma técnica de imagem inicial na PA, mas pode ser útil para as complicações tardias. A ressonância magnética também pode ser mais sensível na avaliação de tecido necrótico em comparação com a tomografia.
Considerações no manejo da PA
Manejo hidroeletrolítico
A terapêutica fluida intravenosa é um pilar do tratamento durante o episódio da PA. A recuperação hidroeletrolítica adequada mantém o estado clínico geral do paciente e sua função renal, mas, recentemente a atenção tem sido focalizada na utilização de fluidos intravenosos para prevenir complicações potenciais da PA, tais como, a necrose e a falência do pâncreas. A patogenia da PA e sua progressão para as formas mais graves é secundária à alteração da microcirculação do pâncreas devido a uma série de eventos que incluem hipovolemia, aumento da permeabilidade capilar e formação de microtrombos (Figura 9).
A reposição fluida além de corrigir a hipovolemia também auxilia na preservação da microcirculação pancreática provendo perfusão adequada e prevenindo a possível formação de microtrombos, e, desta forma, prevenindo o surgimento de complicações e a progressão para doença grave.
Monitoração das manifestações extra pancreáticas
A monitoração dos pacientes na PA fornece indicações precisas de possíveis complicações incluindo a síndrome da resposta inflamatória sistêmica (SRIS) e a falência pancreática. A hipovolemia no momento da hospitalização é um forte preditor de morbidade e mortalidade nos pacientes com PA e parece estar diretamente relacionada com a intensidade da SRIS. A taquicardia tem sido utilizada como um sistema de pontuação para prever a gravidade da PA e o seu retorno ao batimento cardíaco basal tem sido utilizado para comprovar a reposição adequada de fluido associada a monitoração da diurese e o turgor da pele. A variação rotineira da função pulmonar deve ser levada a efeito em todos os pacientes que venham apresentar dificuldade respiratória inexplicada. Lesão renal aguda devido à síndrome do compartimento abdominal ou devido a lesão do túbulo contornado proximal causam aumento da ureia e da creatinina séricas, e, concomitantemente há uma diminuição da diurese o que é uma conhecida complicação precoce da PA. A determinação dos valores da ureia e da creatinina séricas são, portanto, importantes marcadores para o seguimento do manuseio da avaliação fluida e para monitorar a função renal durante as primeiras 48 horas da evolução da PA.
O manejo da dor na PA
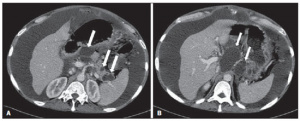
Figura 8 – Pancreatite aguda edematosa com pseudocistos. A,B: Imagens axiais de TC pós-contraste fase venosa mostram alguns pseudocistos comprimindo o parênquima pancreático e outros na retrocavidade dos epíploons (setas).
A dor abdominal é o sintoma mais comumente presente na PA; cerca de 80% a 95% dos pacientes queixam-se de dor abdominal. Dor epigástrica está presente entre 62 e 89% e dor difusa entre 12 e 20% dos pacientes. A clássica apresentação de dor epigástrica com irradiação para as costas ocorre somente entre 1,6% e 5,6% dos pacientes.
A fisiopatologia da PA caracteriza-se pela perda da compartimentalização intra e extra celular, a qual pode resultar a partir de diferentes mecanismos, a saber: obstrução do transporte secretor pancreático, ativação enzimática, ou incapacidade de frear a cascata de ativação inflamatória. A PA ocorre em indivíduos geneticamente susceptíveis nos quais a reação inflamatória provoca a pancreatite. Este fato, por sua vez estimula os receptores de dor viscerais pancreáticos e somáticos peritoneais. Outro mecanismo causador de dor na PA se deve a aumento da pressão no interior da glândula do ducto pancreático com subsequente isquemia do órgão.
O controle da dor é um importante ato terapêutico no manuseio da PA, e como os clássicos analgésicos de ação periférica (tal como o acetaminofeno) são geralmente insuficientes na pancreatite grave, opiáceos são frequentemente necessários para controlar a dor. Uma série de estudos concluiu que os opiáceos devem ser uma escolha apropriada no tratamento da dor relacionada à PA; baseando-se nesta conduta passa-se a necessitar de uma menor quantidade de analgesia suplementar. Em resumo, a utilização de morfina intravenosa ou outros opioides está indicada no alívio da dor na PA, naquelas situações em que o uso de acetaminofeno ou drogas anti-inflamatórios fracassaram.
Nutrição oral e enteral na PA
Tradicionalmente, em passado recente, a proposta nutricional no manejo da PA era jejum oral e nutrição parenteral. A hipótese para justificar tal proposta de pausa alimentar, devia-se à hipótese de que deveria se dar um descanso ao pâncreas e que com esta conduta, ocorreria uma cura mais rápida. O racional que embasava esta teoria seria que a presença do alimento no intestino poderia estimular a liberação da colecistocinina, a qual por sua vez, estimularia a secreção enzimática do pâncreas, e, com isso poderia acarretar uma ativação posterior das enzimas proteolíticas, e, consequentemente exagerar o processo de auto digestão e um agravo da lesão. Inúmeros estudos realizados em adultos portadores de PA demonstraram claramente que a nutrição enteral é preferível sobre a parenteral, e que deve ser utilizada como primeira opção mesmo na presença de fistulas, ascite, e pseudo cistos.
O momento indicado para o início da nutrição enteral deve ser o mais precocemente possível, especialmente tendo como primeiro objetivo prevenir a translocação bacteriana, e, consequentemente o desenvolvimento da SRIS. A terapia nutricional precoce é também pretendida para diminuir a resposta de citocinas, bem como a incidência de gastroparesia e íleo paralitico. Tem sido claramente demostrado que o início da nutrição enteral dentro das primeiras 48 horas de apresentação clínica da PA diminui significativamente as taxas de mortalidade, infecções e falência múltipla dos órgãos em comparação com a nutrição parenteral. Vale ressaltar que o uso da nutrição enteral deve ser considerado “como uma intervenção terapêutica ativa para melhorar o desfecho dos pacientes portadores de PA”.
Nutrição parental na PA (NP)
A nutrição parenteral provê os requerimentos calóricos e nutricionais para compensar o estado catabólico. Uma possível preocupação de que a nutrição parenteral poderia estimular o pâncreas e, desta forma, resultar em um processo exagerado de auto digestão não recebeu suporte na literatura. Em todos os casos quando a nutrição enteral não for possível por um tempo prolongado, tais como íleo paralitico, fistulas complexas e a síndrome compartimental do abdome, a nutrição parenteral tem sido indicada. Por outro lado, estudo recente propõe um retardo no início da nutrição parenteral em até 7 dias nas crianças gravemente enfermas, devido ao aumento do risco de infecção e aumento das taxas de complicação, quando a nutrição parenteral se iniciou dentro das primeiras 24 horas de internação.
Uso de antibióticos na PA
O racional para considerar o uso de antibiótico no manejo da PA relaciona-se à preocupação de infecção bacteriana devido a translocação da microbiota intestinal. Imipenem e/ou cefalosporinas de terceira geração têm sido os antibióticos historicamente mais utilizados na tentativa de reduzir a morbidade e a mortalidade. A abordagem profilática é controvertida posto que estudos prévios sugerem algum benefício, mas, por outro lado, novos estudos não têm demonstrado benefício do uso rotineiro de antibioticoterapia na ausência de infecção documentada. Recentemente, estudos de meta análise dão suporte ao uso de antibióticos no caso de pancreatite necrotizante infectada, porém, não naqueles casos de necrose estéril; a necrose infectada deve ser suspeitada quando o estado clínico do paciente se agrava associado a febre ou na presença de gás no interior de coleções detectada em estudos de imagem. No caso da pancreatite necrotizante são recomendados antibióticos que conhecidamente penetram no tecido necrótico, tais como, carbapenens, quinolonas e metronidazol, posto que, o uso de antibióticos nesta situação tem sido demonstrado com capacidade de postergar intervenções cirúrgicas e diminuem a morbidade e a mortalidade.
Papel da Cirurgia na PA
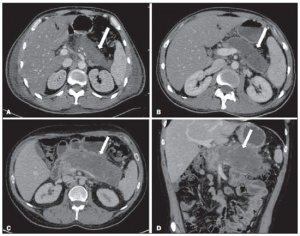
Figura 10 – Necrose pancreática delimitada (walled-off pancreatic necrosis). A,B: Imagens axiais de TC pós-contraste fase venosa. Evolução de pancreatite aguda necrosante. A: Extensa necrose do corpo e cauda pancreáticos de limites indistintos e com aspecto sólido (seta). B: Após duas semanas já pode ser identificada delimitação da área de necrose com aspecto liquefeito e com restos necróticos no seu interior (seta). C,D: Imagens axial (C) e coronal (D) de TC pós-contraste fase venosa. Homem de 42 anos com área de necrose parenquimatosa circunscrita substituindo corpo e cauda do pâncreas (setas), após três semanas da instalação do episódio de pancreatite aguda necrosante.
Intervenções cirúrgicas não fazem parte do algoritmo do manuseio de um episódio típico de PA. Uma indicação precoce de cirurgia inclui o manejo da síndrome compartimental do abdome. O manejo da necrose pancreática com indicação de necrosectomia precoce dentro das primeiras 72 horas tem, entretanto, sido demonstrado acarretar aumento da morbidade e da mortalidade em comparação com esta intervenção de forma tardia além dos 12 dias de enfermidade.
Há recomendação para intervenção precoce para realização de colecistectomia durante a hospitalização devido a um episódio de pancreatite por litíase biliar, e, há também uma discussão quanto ao momento da possibilidade de indicação da colecistectomia versus outras opções terapêuticas nos casos de PA grave, especialmente na presença de necrose.
As indicações para intervenção cirúrgica aguda incluem trauma abdominal, quando o paciente apresenta instabilidade clínica e/ou na busca de uma lesão associada a outro órgão. No contexto da pancreatite biliar a colecistectomia tem sido considerada não somente segura, mas também profilática para evitar futuros episódios de PA. A colicistectomia pode ser realizada de forma segura antes da alta hospitalar nos casos de pancreatite biliar aguda não complicada. No manejo das coleções necróticas agudas, as intervenções devem ser evitadas e postergadas mesmo na necrose infectada, posto que os desfechos são melhores quando a abordagem é postergada além de 4 semanas. Quando a drenagem ou a necrosectomia é necessária, abordagens não cirúrgicas incluindo endoscopia ou métodos percutâneos são preferíveis em comparação com cirurgias abertas de necrosectomia ou drenagem de pseudo císticos.
Expectativas da Evolução e Prognóstico da Pancreatite Aguda
De uma maneira geral as expectativas da evolução da PA na infância são mais favoráveis do que aquelas esperadas para os adultos. O tempo médio de hospitalização na PA varia de 2,8 a 8 dias. Vale ressaltar que lactentes e pré escolares apresentam uma tendência de hospitalizações mais prolongadas, em média 20 dias. O início precoce da nutrição enteral e a rehidratação vigorosa tem sido ligada a um tempo mais curto de hospitalização, menores taxas de admissão a UTI e menores índices de gravidade da enfermidade do que os pacientes que são mantidos em jejum oral. As maiores taxas de mortalidade estão associadas com enfermidades sistêmicas, mas em geral, essas taxas são baixas (menores de 5%).
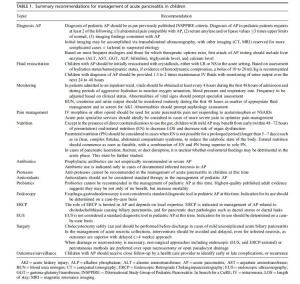 As complicações precoces da PA incluem disfunções multiorgânicas ou choque. Coleções líquidas agudas peripancreáticas são vistas na fase aguda da PA e tendem a serem solucionadas espontaneamente. A frequência da formação de pseudo cisto varia de 8 a 41% na PA, e as taxas mais altas são observadas nos pacientes que sofrem de pancreatite relacionada a trauma abdominal. Os pseudo cistos são geralmente assintomáticos e podem ser conduzidos conservadoramente ou, por outro lado, podem aumentar de tamanho e causar dor abdominal, vômitos e febre. Os pseudos cistos também podem se tornar infectáveis entre 10 a 15% dos casos. Uma outra complicação tardia da PA, refere-se à necrose pancreática. A necrose pancreática pode se manifestar inicialmente como uma coleção necrótica aguda e posteriormente evoluir para necrose encapsulada. As opções de tratamento de drenagem dos pseudos cistos e da necrose encapsulada incluem drenagem endoscópica, drenagem percutânea por cateter ou cirurgia laparoscópica (Figura 10).
As complicações precoces da PA incluem disfunções multiorgânicas ou choque. Coleções líquidas agudas peripancreáticas são vistas na fase aguda da PA e tendem a serem solucionadas espontaneamente. A frequência da formação de pseudo cisto varia de 8 a 41% na PA, e as taxas mais altas são observadas nos pacientes que sofrem de pancreatite relacionada a trauma abdominal. Os pseudo cistos são geralmente assintomáticos e podem ser conduzidos conservadoramente ou, por outro lado, podem aumentar de tamanho e causar dor abdominal, vômitos e febre. Os pseudos cistos também podem se tornar infectáveis entre 10 a 15% dos casos. Uma outra complicação tardia da PA, refere-se à necrose pancreática. A necrose pancreática pode se manifestar inicialmente como uma coleção necrótica aguda e posteriormente evoluir para necrose encapsulada. As opções de tratamento de drenagem dos pseudos cistos e da necrose encapsulada incluem drenagem endoscópica, drenagem percutânea por cateter ou cirurgia laparoscópica (Figura 10).
A técnica escolhida depende do tamanho, localização, anatomia e dos riscos-benefícios do procedimento, embora a drenagem percutânea e a transgastrointestinal guiada tem sido ultimamente as mais universalmente aceitas.
Aproximadamente de 15 a 35% das crianças que sofrem de PA irão apresentar uma nova crise de pancreatite.
A Tabela apresenta um resumo das recomendações do manejo da PA nas crianças.
Referências Bibliográficas
- Abu-El-Haija, M et al: JPGN 2018;66:159-176
- Lowwe, M & Morinville, V: Textbook of Basic Science 2008:184-92
- Abu-El-Haija, M et al: JPGN 2014;58:689-93
- Suzuki, M et al: Pediatr Int 2015;57:113-8
- Szabo, FK et al: Pancreatology 2016;16:358-64
- Kumar, S et al: JAMA Pediatr 2016;170:562-9