O eixo microbiota-intestino-cérebro: da motilidade ao estado emocional
Prof. Dr. Ulysses Fagundes Neto
A renomada revista Gastroenterology publicou um artigo de revisão, em abril de 2021, intitulado “The microbiota-gut-brain axis: from motility to mood”, de Margolis KG e cols., que abaixo passo a resumir em seus principais aspectos.
Introdução
A compreensão de que o cérebro e o intestino coparticipam, de forma contínua, um fluxo de comunicação bidirecional foi reconhecido em tempos tão remotos quanto a Grécia antiga, onde os filósofos Hipócrates, Platão e Aristóteles já haviam postulado que o cérebro e o restante do corpo estão intrinsicamente conectados. Esta noção levou à compreensão de que para estudar o processo das enfermidades, o indivíduo como um todo deve ser levado em consideração, mais do que um sistema de órgão isolado. Entretanto, foi apenas em 1840 que William Beaumont demonstrou experimentalmente que o estado emocional afetava o ritmo da digestão e, assim sendo, que o cérebro afeta o intestino, desta forma concluindo que existe um eixo cérebro-intestino. Embora este conceito tenha sido subsequentemente reconhecido por renomados biólogos incluindo Darwin, Pavlov, James Bernard e Cannon, foi apenas nos primórdios do século XX que, as primeiras observações cientificamente descritas, foram elaboradas para correlacionar as mudanças da fisiologia do trato digestivo com as alterações da emoção. Entretanto, esses estudos resultaram limitados em consequência das técnicas rudimentares existentes, e a inexistência de estudos dos efeitos recíprocos das alterações na fisiologia do trato digestivo sobre as funções mentais. Informações emergentes têm confirmado as conexões entre a saúde do cérebro e do trato digestivo e, além disso, têm sugerido diversos fundamentos mecanicistas. Transtornos na função gastrointestinal e sintomas digestivos têm sido relatados associados a um número cada vez mais crescente de transtornos do Sistema Nervoso Central (SNC), tais como a Síndrome do Intestino Irritável (SII), a qual está frequentemente associada a sintomas psicológicos e diagnósticos psiquiátricos. Além disso, com o advento das imagens do cérebro, as interações reciprocas puderam ser visualizadas pela primeira vez, demonstrando que o estímulo digestivo pode ativar regiões chave do cérebro envolvidas na regulação da emoção.
Inúmeros aspectos da fisiologia gastrointestinal estão sob controle neural, o qual é exercido por meio de uma vasta rede de neurônios entéricos intrínsecos e a glia, que se difundem através do Sistema Nervoso Entérico (SNE), músculo liso do trato gastrointestinal, e a lâmina própria da mucosa, bem como a inervação extrínseca desde as fibras aferentes primárias e autônomas que conectam o intestino à medula espinhal e o cérebro. Embora o SNE regule o peristaltismo intestinal de forma praticamente independente da ação do SNC, sua motilidade é também modulada por fatores intrínsecos ao SNE, incluindo o cérebro e outras divisões sistema nervoso autônomo (SNA), sistema imunológico associado ao intestino, e o microbioma intestinal. A influência sobre o intestino não é unidirecional, pois o intestino também envia informações para esses vários sistemas através de trajetos complexos que funcionam como conduites bidirecionais para a homeostase, e, anormalidades desta comunicação estão associadas a enfermidades. A função adequada do intestino é, portanto, um fator crítico para não somente a sobrevivência a longo prazo, mas também, para a homeostase do eixo cérebro-intestino. A informação precisa de como ocorre a comunicação intestino-cérebro na saúde e na enfermidade em humanos, entretanto, permanece como uma área de ativa investigação.
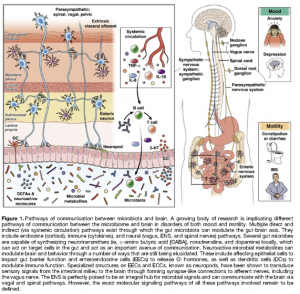
Recentemente, o microbioma intestinal (os trilhões de microrganismos que residem no intestino) surgiu como um participante integral na comunicação intestino-cérebro e por isso passou a ser proposta a designação eixo microbioma-intestino-cérebro. Embora estudos dos mecanismos sobre como esta comunidade de microrganismos em expansão influencia no desenvolvimento do SNE e SNC humano, motilidade gastrointestinal, estado emocional, cognição e aprendizado, ainda estão dando seus primeiros passos, já oferecem propriamente um aspecto potencialmente importante para futuras intervenções terapêuticas (Figura 1).
A microbiota intestinal se comunica com o SNC por meio de canais de sinalização imunológicos neuronais e endócrinos. Por outro lado, o SNC pode afetar a microbiota intestinal de forma direta por meio de expressão genética induzida por mediadores de violência e indiretamente através SNA que intermedia o controle da função intestinal (por exemplo motilidade, modulação imunológica e secreção) (Figura1). Além disso, o SNE pode modular diretamente a composição microbiana por meio de alterações na secreção, motilidade, permeabilidade e defesa imunológica. Estas vias paralelas e de integração estão emergindo para os investigadores na forma de uma matriz complexa de comunicação, a qual também tem sido referida como a conexão intestinal.
Microbiota e o Desenvolvimento do SNC
De uma maneira geral, os processos fundamentais neurais centrais, incluindo o desenvolvimento da mielinização, neurogênese e ativação da microglia, foram demonstrados ser dependentes da composição da microbiota. A evidência mais forte a respeito do papel da microbiota no neurodesenvolvimento veio de pesquisas em camundongos livres de germes (LG). Estudos onde roedores LG foram recolonizados com uma microbiota “normal” em diferentes idades, demonstraram que a recolonização após o desmame é mais eficiente para restaurar as deficiências dos LG do que a recolonização na vida mais tardia, no mínimo, para aspectos específicos do cérebro, função imunológica e comportamento. Além disso, outras funções nos animais LG, tais como, aquelas que afetam a neurotransmissão serotonérgica do SNC, não podem ser restauradas pela recolonização na idade do desmame, sugerindo que a janela para a influência microbiana nestas funções já está fechada.
Embora estes estudos em camundongos LG tenham sido importantes para fornecer evidencias que dão suporte ao conceito de que o microbioma está envolvido nos processos do encéfalo em relação a sinalização de estresse hormonal, função neural e neuro proteção, ainda existem significativas limitações para traduzir estes achados para os seres humanos.
Mecanismos de Sinalização da Microbiota para o Eixo Intestino- Cérebro
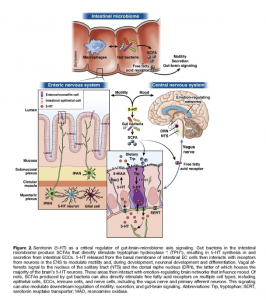
O ramo aferente do nervo vago é o principal conduite que conecta o trato gastrointestinal ao núcleo do trato solitário e a maior rede de regulação da emoção no cérebro dos mamíferos. Embora este ramo aferente não pareça interagir diretamente com a microbiota intestinal, a evidência sugere que o nervo vago pode ser o sensor dos sinais microbianos na forma de metabólitos bacterianos, ou ser influenciado via a modulação mediada pela microbiota sobre as células enteroendócrinas e enterocromafins localizadas no epitélio intestinal (Figura 2).
Por exemplo, as bactérias intestinais produzem metabólitos dos ácidos graxos de cadeia curta, os quais regulam funções fisiológicas intestinais, incluindo aquelas que envolvem a motilidade, a secreção e a inflamação, através dos seus receptores cognatos ácidos livres de gordura. Além disso, outros receptores presentes nas fibras do nervo vago, tais como aqueles para a serotonina e outros receptores intestinais, também podem facilitar essa via de mensagem. Estudos realizados em camundongos vagotomizados, salientam os possíveis papeis exercidos pelo nervo vago, na comunicação do SNC-Microbiota, a qual pode ser traduzida para o estado emocional dos seres humanos e pelos transtornos neurocomportamentais. Por exemplo, em camundongos a vagotomia demonstrou ser capaz de bloquear a sinalização central para as espécies de Lactobacillus e Bifidobacterium, resultando no aprisionamento dos seus efeitos modificadores do estado emocional.
Um sistema bidirecional de comunicação entre a dieta, o microbioma intestinal, as células enterocromafins e o nervo vago, foi recentemente descrito. As células enterocromafins contém mais de 80% da serotonina corporal, e, a síntese e a liberação da serotonina pelas células enterocromafins é modulada pelos ácidos graxos de cadeia curta e 2BAs produzidos por esporos formadores de Clostridiales. Estes microrganismos aumentam suas ações estimulantes sobre as células enterocromafins induzindo a uma aumentada disponibilidade do triptofano dietético. As células enterocromafins também se comunicam com as fibras aferentes do nervo vago, através de conexões sinápticas de extensões similares aos neuropódios das células enterocromafins. Por outro lado, o SNA pode ativar as células enterocromafins para liberar serotonina no lúmen intestinal, onde ela pode se unir aos mecanismos de transporte similares à serotonina e influenciar na função da microbiota intestinal.
Serotonina: um regulador chave do eixo microbioma-intestino-cérebro no intestino e no cérebro.
Há crescentes evidências de que a serotonina é um dos fatores chaves do eixo microbioma-intestino-cérebro com sinalização no cérebro, no intestino e na comunicação intestino para o cérebro. De fato, estudos recentes tem demonstrado que bactérias especificas formadoras de esporo, tanto em seres humanos como em camundongos, aumentam os níveis colônicos e sorológicos de serotonina, e regulam a dismotilidade intestinal pela produção de ácidos graxos de cadeia curta devido ao aumento da produção da serotonina (Figura 2). Evidências recentes sugerem que a serotonina liberada pelas células enterocromafins, se comunica com um microbiota intestinal, Turibacter sanguinis, o qual possui mecanismos de captação da serotonina, a qual está envolvida na sua colonização e na fisiologia do hospedeiro. A microbiota intestinal também tem sido demonstrada ser capaz de induzir a maturação do SNE adulto via ativação dos receptores de serotonina. Finalmente, a microbiota intestinal também pode atuar através de precursores do neurotransmissor; a microbiota intestinal pode influenciar a neurotransmissão serotonérgica por meio da regulação da disponibilidade do precursor da serotonina, o triptofano.
Microbioma Intestinal e Depressão
Recentemente, uma série de inúmeros estudos tem demonstrado que pacientes com transtorno depressivo major, possuem uma composição alterada do microbioma intestinal em comparação com controles sadios, embora a natureza dessas alterações em cada um desses estudos seja diversa. É importante notar que esses estudos também têm demonstrado que a transferência do microbioma de um individuo deprimido, para um roedor sadio, pode induzir comportamentos similares à depressão no recipiente, o que sugere a possibilidade de um papel causal da microbiota na fisiopatologia da depressão, e, desta forma abrir o conceito de ser o microbioma como alvo para um benefício da saúde mental.
Conclusões
Consideráveis progressos têm sido alcançados na compreensão do eixo microbioma-intestino-cérebro em modelos pré-clínicos de transtornos cerebrais humanos e no potencial de tradução desses achados para os seres humanos. Um crescente corpo de pesquisa tem confirmado que interações de transtornos cérebro-intestino, como por exemplo a Síndrome do Intestino Irritável (SII), apresentam um forte componente cerebral, e que inúmeros transtornos cerebrais tem uma faceta do trato gastrointestinal presente nas suas manifestações ou mesmo origens. Um papel causal do microbioma intestinal e estas interações ainda necessita ser determinado. Este importantíssimo conhecimento, acarretará o desenvolvimento de abordagens terapêuticas multidisciplinares em futuro próximo.
Referências Bibliográficas
- Margolis KG e cols: Gastroenterology 2021;160: 1486-1501
- Drossman DA: Gastroenterology 2016;150:1262-1279
- Bowe C e cols.: J Neurophysiol 2019; 121:1856-1864
- Gilbert JA e cols: Nature Med 2018;24:392-400