Doença Celíaca: apresentação clínica nas crianças da Europa Central
Prof. Dr. Ulysses Fagundes Neto
A renomada revista JPGN de abril de 2021, publicou um importante artigo de autoria de Riznik P. e cols., intitulado “Clinical Presentation in Children with Coeliac Disease in Central Europe” que a seguir passo a abordar em seus aspectos de maior relevância.
Introdução
A Doença Celíaca (DC) trata-se de uma enfermidade autoimune sistêmica e permanente, provocada pelo glúten e suas prolaminas nos indivíduos geneticamente suscetíveis, e é uma das enfermidades crônicas mais frequentes, afetando cerca de 1% da população. A DC pode se apresentar das formas mais variadas, envolvendo o trato digestivo, com sintomas extra intestinais e mesmo de forma assintomática. Em virtude do seu componente genético a DC é mais comum entre membros familiares de indivíduos afetados, e está associada com várias outras condições clínicas, incluindo diabete melito tipo I, deficiência de IgA, tireoidite autoimune e mesmo algumas anomalias cromossômicas, tais como as síndromes de Down, Turner ou Willians.
Os sintomas da DC podem ser atribuídos a uma combinação de inflamação, deficiência nutricional causada por má absorção e resposta autoimune à enzima transglutaminase tecidual. No passado, a DC foi reconhecida como uma enfermidade da infância, com apresentação clínica característica de diarreia com síndrome de má absorção. Atualmente, sabe-se que a DC é uma enfermidade sistêmica que pode ocorrer em qualquer idade e não está limitada ao trato digestivo. Manifestações extra intestinais desta enfermidade podem afetar quase todos os órgãos, incluindo o sistema nervoso, fígado, pele, sistema reprodutor, sistema cardiovascular e sistema músculo esquelético, e estão frequentemente associadas com quadro clínico e histológico mais graves. Vale enfatizar, que algumas destas manifestações podem surgir frequentemente na infância, enquanto outras podem aparecer na vida adulta ou em idades avançadas.
Inúmeros estudos têm demostrado uma mudança gradual das manifestações clínicas da DC, variando desde os historicamente clássicos sintomas de má absorção, para nos tempos atuais, apresentar as manifestações não clássicas, oligo sintomáticas ou mesmo as formas assintomáticas.
O objetivo do presente estudo foi avaliar apresentação clínica da DC em crianças e adolescentes da Europa Central (Mapa).
Métodos
O presente estudo foi conduzido envolvendo 12 parceiros de 5 países da Europa Central, a saber: Croácia, Alemanha, Hungria, Itália e Eslovênia os quais participaram do projeto. Para a obtenção dos dados dos pacientes foi elaborado um questionário específico que incluiu perguntas a respeito das manifestações clínicas da DC. Os Gastroenterologistas Pediátricos destes países foram estimulados para o preenchimento dos questionários a respeitos dos dados clínicos de seus pacientes.
Foram estudados de forma diferenciada os dados clínicos entre os pacientes menores de 3 anos, pré-escolares (3-6 anos) e escolares (6-18 anos). Também foi avaliada a correlação do retardo diagnóstico com a apresentação clínica e sua respectiva abordagem diagnóstica. Diferenças regionais relativas aos parâmetros estudados foram analisadas.
Resultados
Foram obtidos dados de 653 crianças e adolescentes (mediana 7,2 anos; 134 crianças; 20,5% eram assintomáticas no momento da confirmação do diagnóstico (mediana 7,5 anos); as outras crianças foram diagnosticadas com DC em virtude dos seus sinais e sintomas (mediana 7,2 anos; 64,7% meninas). Não houve diferença significativa na idade, no momento do diagnóstico entre as crianças sintomáticas e as assintomáticas.
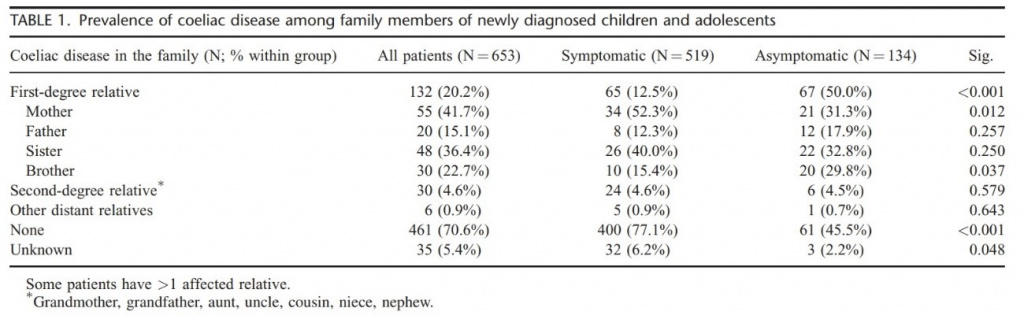
A existência de DC em outros membros da família foi observada em 24% das crianças (Tabela 1). A ocorrência de DC em parentes de primeiro grau mostrou-se significantemente maior no grupo de crianças assintomáticas (50% versus 12,5%; p<0,0001). As mães foram os membros familiares mais frequentemente afetados (41,7%).
Um pouco mais de um quarto de todas as crianças e adolescentes (177; 27,1%) pertenciam ao grupo de alto risco para a ocorrência de DC devido à história familiar positiva, outras comorbidades autoimunes ou mesmo outras condições clínicas. Não houve diferença significante entre os sexos dos pacientes com DC pertencentes (n = 177; 60,4% meninas) e não pertencentes (n=476; 65,1% meninas) a quaisquer grupos de alto risco (p= 0.155).
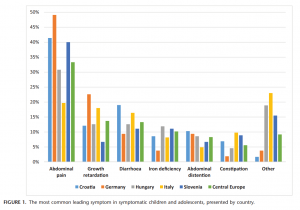
O principal sintoma mais comum nas crianças sintomáticas (n=519) foi dor abdominal (33,3%), o segundo sintoma mais frequente foi retardo do crescimento (13,7%), seguido por diarreia (13,3%) e deficiência de ferro (10,2%) (Figura 1). Dentre todos os sintomas referidos, dor abdominal foi novamente o sintoma mais comum (41,2%), seguida de distensão abdominal (25,7%) e diarreia (24,3%).
A maioria das crianças sintomáticas (47,6%; n=247) era poli sintomática, referindo 3 ou mais sintomas, seguido pelas crianças mono sintomáticas (28,5%; n=148). Dentre as crianças mono sintomáticas, os sintomas mais frequentes foram dor abdominal (29,7%), seguida por retardo do crescimento e deficiência de ferro (16,9% e 14,2%, respectivamente). Dentre as crianças poli sintomáticas, a dor abdominal foi o sintoma mais comum (66,4%), seguida por distensão abdominal e diarreia (56,7% e 54,2%, respectivamente).
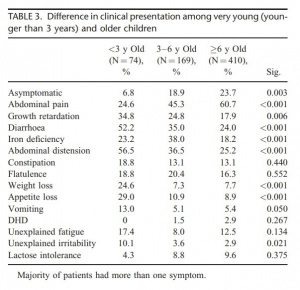
Também foi realizada a comparação das apresentações clínicas entre as crianças muito jovens, pré-escolares e escolares. Dor abdominal foi a manifestação clínica mais frequente em ambos os grupos etários, pré-escolares (21,3%) e escolares (31,7%). No grupo das crianças muito jovens, diarreia foi o sintoma mais frequente (23%), seguida de retardo do crescimento (16,2%) e distensão abdominal (14,09%). Entre as crianças pré-escolares, os segundos sintomas mais frequentes foram deficiência de ferro e retardo do crescimento (ambos 11,08%), e nas crianças escolares o segundo sintoma mais frequente foi o retardo do crescimento (9,5%) seguido de diarreia (8,03%). Entre as crianças muito jovens, (6,08%) eram assintomáticas, nas pré-escolares (18,09%) e nas escolares (23,7%) (p<0,05). Com relação aos sintomas entre as crianças muito jovens, pré-escolares e escolares, foi observada uma diferença estatisticamente significante para dor abdominal (p<0,01), diarreia e distensão abdominal (ambos p<0,05). No que diz respeito à totalidade dos sintomas, má absorção foi significantemente mais frequente nas crianças muito jovens em comparação com as outras (p<0,001); por outro lado, dor abdominal mostrou-se mais frequente nos pré-escolares e adolescentes (p<0.01). Vale assinalar que DC assintomática foi mais frequente entre as crianças maiores (p<0,05) (Tabela 3).
Discussão
A idade das crianças por ocasião do diagnóstico foi 7 anos, e revelou-se ser superior a aquela observada em décadas passadas. A maioria das crianças era do sexo feminino, o que tem sido descrito em investigações prévias. Está bem estabelecido que a DC é mais prevalente entre os parentes de primeiro grau de pacientes com DC, ocorrendo em até 10% ou mesmo acima deste valor. Entretanto, no presente estudo, a ocorrência entre os membros familiares aconteceu próximo a 25% deles.
O sintoma mais frequentemente detectado neste estudo foi dor abdominal, seguido de retardo do crescimento, diarreia e deficiência de ferro. Dor abdominal mostrou-se mais frequente nas crianças pré-escolares e escolares; por outro lado, nas crianças mais jovens, diarreia foi detectada mais comumente do que nas crianças maiores. A clássica tríade de sintomas da DC (diarreia crônica, retardo do crescimento e distensão abdominal) foi observada principalmente nas crianças mais jovens, e com o aumento da idade, os sintomas atípicos tornaram-se mais frequentes.
Vale ressaltar que, a DC assintomática tem se tornado cada vez mais prevalente, e, estudos de rastreamento investigando adolescentes aparentemente sadios, a DC tem sido detectada em cerca de 1% das crianças assintomáticas, que não apresentam história familiar de DC. No presente estudo, 1/5 das crianças investigadas relataram ausência de sintomas e na verdade foram majoritariamente diagnosticadas por meio de rastreamento laboratorial por pertencerem a populações de grupo de risco.
Meus Comentários
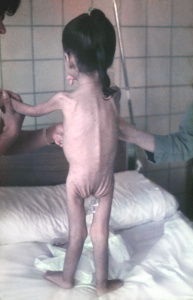
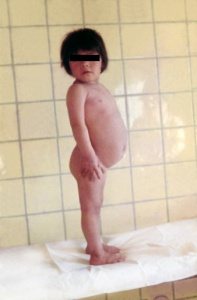
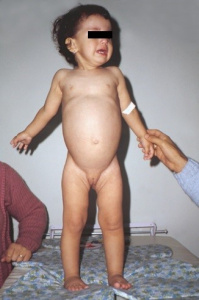
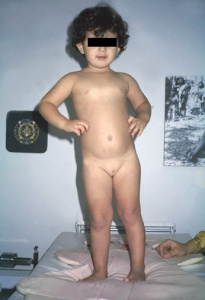
Há 50 anos, quando iniciei meu treinamento em serviço no programa de Residência Médica em Pediatria no Hospital São Paulo da Escola Paulista de Medicina, nosso problema mais crucial de saúde pública na infância respondia pelo binômio diarreia-desnutrição, responsável pela maior causa de mortalidade em crianças menores de 5 anos de idade. Naquela ocasião, DC não fazia parte sequer do diagnóstico diferencial daquele problema médico, tudo era diretamente atribuído a causas das iniquidades sociais vivenciadas por parcelas significativas da nossa população, sendo verminoses e gastrenterite infecciosa supostamente os grandes causadores do supracitado binômio. Entretanto, quando em 1973 fui fazer minha especialização em Gastropediatria no serviço do Dr. Horácio Toccalino, pioneiro da Gastropediatria na América Latina, no Policlínico Alejandro Posadas, em Buenos Aires, tive para minha surpresa logo de início das minhas atividades clínicas, o meu primeiro contato com a DC. Tratava-se de uma criança profundamente desnutrida, com as mesmas características daquelas crianças desnutridas que eu havia tão frequentemente vivenciado em São Paulo, durante os 2 anos prévios (Figuras 2-3).
Figuras 2-3- As primeiras pacientes portadores de DC por mim vivenciadas no Policlínico Alejandro Posadas, no momento do diagnóstico e após alguns meses de dieta isenta de glúten, evidenciando total recuperação clínica e nutricional.
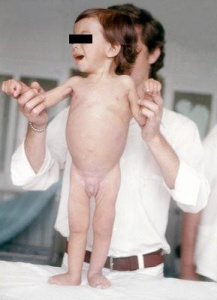
Ao me deparar com a figura daquela criança, a partir de então passei a ter a mais absoluta certeza de que a DC também existia entre nós. De fato, logo após meu regresso tive a oportunidade de comprovar de forma documentada com a biópsia do intestino delgado o primeiro caso da enfermidade no Brasil (Figuras 4-5)
Figuras 4-5- O nosso primeiro paciente diagnosticado como DC no momento do diagnóstico e alguns meses após a introdução da dieta isenta de glúten evidenciando total recuperação clínica e nutricional.
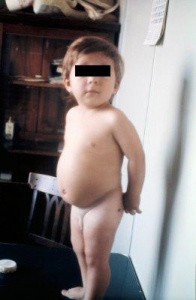
Após esta primeira descrição muitos outros casos, até então, rotulados como pacientes portadores de desnutrição devido a verminose ou mesmo desnutrição por problemas de natureza socioeconômica, vieram a ser devidamente diagnosticados como DC. Ainda assim, continuava-se a considerar a DC como uma enfermidade rara mesmo nas classes sociais mais abastadas (Figuras 6-7).
Figuras 4-5- O nosso primeiro paciente diagnosticado como DC no momento do diagnóstico e alguns meses após a introdução da dieta isenta de glúten evidenciando total recuperação clínica e nutricional.
Após esta primeira descrição muitos outros casos, até então, rotulados como pacientes portadores de desnutrição devido a verminose ou mesmo desnutrição por problemas de natureza socioeconômica, vieram a ser devidamente diagnosticados como DC. Ainda assim, continuava-se a considerar a DC como uma enfermidade rara mesmo nas classes sociais mais abastadas (Figuras 6-7).
Figuras 6-7- Paciente da minha clínica privada no momento do diagnóstico e após a recuperação clínica e nutricional, evidenciando o aspecto da retomada da alegria de viver que havia sido perdida, fato muito comum nos pacientes portadores de DC.
Por outro lado, embora a biópsia do intestino delgado ainda seja considerada absolutamente necessária para a confirmação diagnóstica da DC, a introdução dos testes sorológicos de rastreamento, a partir da década de 1980, em especial o Anticorpo Antitransglutaminase, trouxe uma enorme contribuição para identificar quais indivíduos devem ser submetidos ao procedimento da biópsia duodenal. Além disso, é fundamental enfatizar que estes testes passaram a ser utilizados para o rastreamento populacional, o que veio a permitir desvendar o que se convencionou denominar a parte submersa do “iceberg” da DC. Esta nova ferramenta laboratorial possibilitou estabelecer as taxas de prevalência da DC nas mais diversas comunidades, e, mais ainda, permitiu o conhecimento das formas atípicas e mesmo as assintomáticas da DC.
Figuras 6-7- Paciente da minha clínica privada no momento do diagnóstico e após a recuperação clínica e nutricional, evidenciando o aspecto da retomada da alegria de viver que havia sido perdida, fato muito comum nos pacientes portadores de DC.
Por outro lado, embora a biópsia do intestino delgado ainda seja considerada absolutamente necessária para a confirmação diagnóstica da DC, a introdução dos testes sorológicos de rastreamento, a partir da década de 1980, em especial o Anticorpo Antitransglutaminase, trouxe uma enorme contribuição para identificar quais indivíduos devem ser submetidos ao procedimento da biópsia duodenal. Além disso, é fundamental enfatizar que estes testes passaram a ser utilizados para o rastreamento populacional, o que veio a permitir desvendar o que se convencionou denominar a parte submersa do “iceberg” da DC. Esta nova ferramenta laboratorial possibilitou estabelecer as taxas de prevalência da DC nas mais diversas comunidades, e, mais ainda, permitiu o conhecimento das formas atípicas e mesmo as assintomáticas da DC.
Uma comprovação insofismável de que a DC não é rara no Brasil foi estabelecida pela tese de Mestrado do Biomédico Ricardo Palmero, que sob minha orientação, em 2007, incluiu 3000 indivíduos candidatos voluntários a doadores de sangue. Neste estudo realizou uma investigação com o objetivo de determinar a prevalência da DC na cidade de São Paulo com o emprego do Anticorpo Antitransglutaminase e com subsequente confirmação diagnóstica pela biópsia duodenal, e que resultou positiva em 1,5% (45/3000) dos investigados (“High prevalence of celiac disease in Brazilian blood donors volunteers based on screening by IgA antitissue transglutaminase antibody” Palmero R., Fagundes-Neto, U et al. – European Journal of Gastroenterology and Hepatology 19: 43-9, 2007). Isto posto, ficou de forma cabalmente demonstrada que a DC não é uma enfermidade rara em nosso meio, muito ao contrário, e cuja prevalência é similar à de outros países do mundo ocidental.
Referências Bibliográficas
- Riznik P e cols.- JPGN 2021; 72:546-51.
- Husby S e cols. J Pediatr Gastroenterol Nutr 2020; 70:141-56.
- Lebwohl B e cols. Lancet 2018; 391:70-81.
- Kurppa K e cols. Lancet 2018; 2:133-43.