El páncreas exocrino en la fibrosis quística: diagnóstico de la insuficiencia pancreática
ASPECTOS NUTRICIONALES Y GASTROENTEROLÓGICOS DE LA FIBROSIS QUÍSTICA
Coordinadora: Dra. Lucrecia Suarez Cortina (España)
Coordinadora. Subtema: Silvana Dadán (Colombia)
Autores: Ana de Blás (España), Silvana Dadán (Colombia), Wilson Daza Carreño (Colombia), Luis Peña Quintana (España), Marta Wagener (Argentina), Lucrecia Suárez Cortina (España)
Introducción
La fibrosis quística (FQ) es la causa más frecuente de insuficiencia pancreática exocrina en la infancia. Más de tres de cada cuatro pacientes con FQ tienen mayor o menor grado de afectación pancreática y como consecuencia, una digestión incompleta de los nutrientes, especialmente de grasas y vitaminas liposolubles.
La región endocrina del páncreas suele estar preservada relativamente durante años, pero con la edad los islotes de Langerhans llegar a sustituidos por estroma fibro-adiposo.
Dada la gran capacidad de reserva del páncreas, los signos y síntomas de la insuficiencia pancreática (IP) no se ponen de manifiesto hasta que la función está ya muy alterada. La esteatorrea es la manifestación clínica más importante y es consecuencia de la falta de lipasa en la luz intestinal, interviniendo también el pH ácido en el duodeno y la alteración de la constante de disociación (pK) de las sales biliares. En definitiva, la IP lleva a una malabsorción de grasas y proteínas, que no se aprecia hasta que la destrucción del páncreas es mayor del 90 % (1).
Se estima que alrededor del 85 al 90% de los pacientes con FQ son insuficientes pancreáticos, aunque cada vez es más frecuente la detección de la enfermedad en pacientes con manifestaciones más leves y con mutaciones atípicas, lo que conlleva un aumento de la prevalencia de pacientes con suficiencia pancreática (SP).
En general, la IP se presenta desde las primeras semanas de vida en los pacientes que tienen mutaciones severas, pero es importante tener siempre en cuenta el carácter evolutivo de la enfermedad y que la disminución de la actividad del páncreas exocrino puede ser progresiva, instaurándose a lo largo de los primeros meses o años de vida. Por esto, todos los pacientes con SP que tengan al menos una mutación de CFTR grave o desconocida deben ser evaluados periódicamente por la alta probabilidad de que evolucionen a una IP. La pancreatitis aguda recurrente y crónica, más frecuente en pacientes con FQ que en la población normal, aparece en la mayoría de los casos en pacientes con SP y puede ser el primer síntoma de presentación, incluso antes de que se llegue al diagnóstico de FQ.
La IP sin tratamiento aboca a la desnutrición como resultado de la mal digestión y malabsorción de macronutrientes y de micronutrientes. El síndrome de malabsorción que acompaña a la IP es de aparición precoz, constituyendo una manifestación severa de la enfermedad. Los síntomas y signos más expresivos son: diarrea con heces muy fétidas, voluminosas y con eliminación aumentada de grasa, escasa ganancia ponderal y molestias abdominales.
La malnutrición, el fracaso del desarrollo y la alteración pulmonar crónica guardan una estrecha relación con el pronóstico y la supervivencia de estos enfermos.
Relación genotipo- fenotipo
Las mutaciones responsables de la FQ afectan a la proteína CFTR a través de una amplia variedad de mecanismos moleculares, que pueden producir desde una ausencia total de la función de esta proteína a una alteración leve. Esta variación genotípica es la base de la variabilidad del fenotipo, según las diferentes mutaciones (2).
Las mutaciones denominadas graves (clases I – II – III y VI) son responsables de las formas que cursan con insuficiencia del páncreas exocrino y manifestaciones clínicas más graves.
Las mutaciones leves (clases IV y V) suelen cursar con formas clínicas menos graves y con suficiencia pancreática, aunque es fundamental realizar un seguimiento estrecho de los pacientes con este tipo de mutaciones, ya que, en ocasiones, se ha visto que la función pancreática puede evolucionar de la suficiencia hacia la insuficiencia (3).
En la actualidad hay descritas más de 1.900 mutaciones.
Las mutaciones por sí mismas no explican las diferencias del fenotipo que se encuentran en los pacientes y actualmente se acepta que es importante el papel que juegan los llamados genes moduladores, descritos recientemente, que pueden influir en la expresión clínica de la enfermedad y colaborar, de esta manera, explicando la amplia variabilidad fenotípica. Hoy se acepta también que estos genes tienen más influencia sobre la afectación pulmonar que en la pancreática.
Estudio de la función del páncreas exocrino y diagnóstico de IP
En torno al 85% de los pacientes con FQ tienen un mayor o menor grado de afectación pancreática y como consecuencia una maldigestión y malabsorción de nutrientes, especialmente de grasas y vitaminas liposolubles, que si no se corrige produce un estado de malnutrición. Por esto, es importante determinar, desde el momento del diagnóstico, si existe o no insuficiencia pancreática.
Existen múltiples técnicas para estudiar la función del páncreas exocrino, aunque pocas reúnen las características adecuadas para ser utilizadas en la práctica clínica pediátrica.
El diagnóstico de presunción se realiza con los datos de la historia clínica, la observación de las heces y la valoración del estado nutricional.
El estudio directo es complicado, ya que precisa métodos invasivos para acceder a la extracción del jugo duodenal. Existen otras pruebas indirectas, menos específicas y sensibles, pero que bien manejadas son muy útiles, sensibles y específicas, para cuantificar la maldigestión y controlar la respuesta a las medidas terapéuticas.
Tabla II: Pruebas recomendadas para el estudio de la función del páncreas exocrino en FQ
1- Pruebas directas: aspiración del jugo duodenal por sondaje o endoscopia, tras estimulación alimentaria o enzimática
2- Pruebas indirectas
- 2.1 Estudios en heces
- Macro-microscópico
- Esteatocrito
- Elastasa 1 fecal
- Quimiotripsina
- Cuantificación de grasa (Van de Kamer / Fenir)
- 2.2 Pruebas del aliento
- 2.3 Otros
- Colangiopancreatografía con Resonancia Magnética (CPRM) y estimulación hormonal
- Pruebas orales
1- Pruebas directas: cuantificación de enzimas pancreáticas en jugo duodenal tras estimulación alimentaria o con hormonas
Es el test estándar para el estudio de la función pancreática exocrina. Con el paciente en ayunas se procede mediante intubación duodenal con sonda de doble luz o mejor con endoscopio, a la aspiración duodenal tras estimulación de la secreción pancreática con secretina, 1U/kg en bolo y posteriormente 1U/kg + ceruleina 120 ng/kg en infusión continua iv. Después, se procede a la medición del volumen, concentración de bicarbonato y actividad de enzimas pancreáticas en el jugo duodenal obtenido a intervalos de 10 minutos. Las enzimas se inactivan rápidamente en el jugo duodenal, por lo que se requiere procesarlas muy de prisa. Para suplir este problema que afecta con frecuencia los resultados, actualmente se ha demostrado que la concentración del cinc en el jugo duodenal, que es muy estable y guarda una estrecha correlación, es un indicador bueno de la secreción de enzimas y es más fácil de medir (con una sensibilidad y una especificidad del 97% y 91% respectivamente) (4).
Ventajas: Este test es el único que mide directamente la concentración de enzimas pancreáticas.
Desventajas: Es invasivo e incómodo para el paciente, difícil de realizar, poco fisiológico (sobre estimulación pancreática) y costoso. Los resultados son, en bastantes ocasiones, poco concluyentes.
Comentarios: No se recomienda en la práctica clínica habitual.
2- Pruebas indirectas: miden las consecuencias de la insuficiencia pancreática, no son invasivas, suelen ser sencillas de realizar y proporcionan información coste–eficiencia, tanto para diagnóstico de IP, como para controlar la respuesta a la terapia de reemplazo enzimático (TRE).
2.1. Estudios en heces
2.1.1 Estudio microscópico de heces
Puede hacerse con una muestra aislada de heces y permite observar la cantidad de gotas de grasa neutra, cristales de ácidos grasos, jabones cálcicos y fibras musculares sin digerir, así como granos de almidón. Es una prueba muy poco específica y muy variable, que depende del observador. No se recomienda su uso excepto, en situaciones donde se carezca de otros recursos.
2.1.2 Esteatocrito
Consiste en el análisis semicuantitativo de una muestra de heces. Es una determinación semicuantitativa y poco exacta.
Se realiza con una pequeña cantidad de heces, homogeneizada y centrifugada a 15.000 rpm durante 15 minutos en un tubo de hematocrito, donde se obtienen 3 fases: fase lipídica en lo alto, fase acuosa líquida debajo y la fase residual en el fondo. El contenido de grasa de las heces se expresa como porcentaje de la longitud total de la columna sólida, calculándose mediante la fórmula: Esteatocrito (%)= Grasa/(Grasa + Sólido)x100.
Ventajas: Es fácil de reproducir, económica y rápida, no requiere demasiadas habilidades y se evalúa con una muestra pequeña y única de heces.
Combinar el esteatocrito con la ganancia ponderal, podría ser una alternativa para el diagnóstico de aproximación de IP, cuando no esté disponible la determinación de elastasa 1 fecal ni la cuantificación de grasa en heces. Si el paciente presenta una ganancia de peso inferior al percentil 10 o se evidencia una caída en la curva pondero – estatural y tiene además alteración del esteatocrito, debe instaurarse de inmediato la terapia de reemplazo enzimático, aunque siempre es necesario a posteriori, confirmar la IP con la determinación de E1F (5).
Desventajas: Poco sensible. Menos efectiva en niños mayores por la dieta más diversificada.
Comentarios: Uso restringido a situaciones donde no es posible otra alternativa y necesidad de reconfirmar resultados.
2.1.3 Elastasa fecal
La elastasa fecal (EF) es una proteasa específica, secretada por el páncreas, que pasa a través de todo el trayecto intestinal, sin ser absorbida ni degradada, eliminándose por las heces. Cuando existe una IP, la elastasa se segrega en muy escasa concentración y por tanto, su eliminación en heces es también escasa. Además, la ingesta concomitante de enzimas exógenas no altera sus niveles de excreción.
Se puede aplicar a lactantes mayores de 2 semanas, independientemente de la edad gestacional, del peso al nacer y del tipo de alimentación, pero su exactitud es cuestionable en el recién nacido a término en las primeras 2 semanas de vida. La edad en el momento de la determinación en los primeros 15 días de vida es un factor fundamental, ya que no discrimina entre inmadurez o insuficiencia pancreática (6).
Existen 2 test comerciales:
- ScheBo Biotech, Giessen, Germany: usa un anticuerpo monoclonal, con una sensibilidad de 98% a 100% y una especificidad de 93% a 100% para IP, incluso mientras los pacientes estén tomando suplementos de enzima pancreáticos.
- Bioserv Diagnostics, Rostock, Germany: usa un anticuerpo policlonal, con la misma especificidad, pero menor sensibilidad.
Los valores de referencia son:
- > 200 µg/g heces: Función pancreática normal
- 100-200 µg/g heces: Insuficiencia pancreática moderada
- < 100 µg/g heces: Insuficiencia pancreática severa
Es la prueba más aceptada para diagnóstico de IP, ya que es cómoda para el paciente, precisa, fácil de realizar y permite determinar el grado de afectación.
Ventajas: Cómoda para el paciente, se mide en una muestra única y pequeña de heces, fácil de realizar, no requiere tecnología sofisticada. Su correlación con la prueba de secretina ceruleina es alta. Es más sensible y específica que la quimotripsina. Hay suficiente bibliografía que demuestra una sensibilidad entre el 98% y 100% en IP graves y del 75% al 100% en las moderadas, así como una especificidad cercana al 93%. Además, puede utilizarse en pacientes con terapia de reemplazo enzimático.
Desventajas: es relativamente costosa, es necesario realizar un número importante de muestras para abaratar costos. Es preciso tener en cuenta que algunas alteraciones del intestino delgado, como el síndrome del intestino corto, la enfermedad de Crohn y la atrofia de las vellosidades pueden disminuir su sensibilidad.
Es importante considerar que la presencia de heces líquidas puede generar falsos positivos
Comentarios: Puede considerarse la prueba indirecta más eficiente para valorar el fracaso de la secreción del páncreas exocrino y debe ser el estándar del diagnóstico de IP en los pacientes con fibrosis quística (7)
2.1.4 Excreción de quimotripsina
El valor de referencia que se emplea es
- <3 UI/g de heces: actividad anormal de la quimotripsina
Ventaja: Se mide en una muestra única y pequeña de heces, fácil de realizar, no requiere tecnología sofisticada.
Desventaja: Puede verse afectada durante el tránsito intestinal y puede diluirse en presencia de diarrea. Además, es necesario suspender la toma de enzimas exógenas durante dos días antes de tomar la muestra.
Comentarios: No se recomienda como método diagnóstico de IP, ya que no ha demostrado ser tan precisa como la elastasa (8) (9).
2.1.5 Cuantificación de grasa (Van de Kamer / Fenir) con determinación del coeficiente de reabsorción de grasas (CRG)
La cuantificación de la excreción de grasa en heces de 72 horas por el método de Van de Kamer o por el FENIR (espectroscopía de reflectancia en infrarrojo cercano) es un método indirecto no invasivo que permite una aproximación para determinar el grado de alteración pancreática y su repercusión funcional sobre la digestión de las grasas. Es engorroso, ya que requiere recoger todas las heces durante un período mínimo y continuado de 72 horas, lo que suele ser mal aceptado por el paciente. Los periodos más cortos de recolección condicionan mayor margen de error en los resultados.
La información de la esteatorrea se enriquece con el CRG, que relaciona la grasa excretada frente a la grasa ingerida:
– CRG = grasa ingerida – grasa excretada / grasa ingerida X 100.
Se expresa en % y debe ser superior al 85% en menores de 3 meses y de 93% en mayores de 3 meses (10). Su determinación requiere realizar simultáneamente, durante los 3 días de recolección de las heces una encuesta dietética precisa. Un CRG bajo indica un mal control de la IP y requiere un ajuste de la terapia de reemplazo enzimático (TRE).
La determinación de la esteatorrea es la prueba más idónea para valorar el cumplimiento y respuesta al tratamiento enzimático.
Los valores patológicos de referencia son: > 3,5 g de grasa por día, aunque esta cifra debe validarse en cada laboratorio.
Ventajas: Es la prueba de elección para valorar la respuesta a la administración de enzimas exógenas y posterior control evolutivo.
Desventajas: Engorrosa. Requiere la recolección de todas las deposiciones durante 3 días consecutivos y es poco aceptada por pacientes y familiares. Requiere disponer de tecnología específica para cuantificar los nutrientes en heces (FENIR), ya que la metodología manual tradicional no es aceptada por los técnicos de laboratorio, por lo desagradable que es la manipulación de las heces.
Es inadecuada para diagnosticar IP, ya que no distingue la IP de otros síndromes de malabsorción (atrofia severa de las vellosidades intestinales, alteración de las sales biliares, disbiosis, etc.) En pacientes con estreñimiento o con tránsito lento, debe aumentarse el tiempo de recolección de las heces hasta 5 días o cuantificarse la recolección de cada día por separado.
Conclusiones: La cuantificación de grasa en heces y el CRG permiten una aproximación útil para valorar indirectamente la IP, pero principalmente para controlar el cumplimiento y respuesta a la TRE.
2.2 Pruebas del aliento
Se basan en administrar una comida junto con un sustrato marcado con carbono 13 y tomar la muestra del aliento antes y cada 30 minutos después de la administración de la misma, durante al menos 6 horas. Los marcadores más empleados para valorar la actividad lipasa son: los triglicéridos (hioleína, trioleina, tripalmitina y triactoina). Cuando la hidrólisis es adecuada, los marcadores son absorbidos, metabolizados y finalmente liberados por el endotelio pulmonar como CO2, que se cuantifica por espectrometría de masas o por análisis de infrarrojos. El 13CO2 recogido en aire espirado es directamente proporcional a la cantidad de grasa digerida en el intestino. Su excreción refleja el proceso completo desde la ingesta, vaciamiento gástrico, digestión enzimática, absorción y oxidación del substrato, hasta la exhalación del producto final del metabolismo en el aliento.
Ventajas: Reflejan la actividad de las enzimas pancreáticas en condiciones fisiológicas y no son invasivos. Se pueden usar en niños y en embarazadas. No se afectan por la TRE.
Desventajas: Poco sensibles y específicos, requieren ayunos largos y tiempo largos de estancia en el hospital (alrededor de 6 – 8 horas) para la toma de las muestras, lo que los hace incómodos para el paciente. No están bien estandarizados y son costosos.
Comentario: Se encuentran en investigación test de aliento cortos para la valoración de la función pancreática exocrina y el control de la terapia de reemplazo enzimático. Los actuales no se recomiendan en la práctica clínica habitual.
2.3 Otros
2.3.1 Colangiopancreatografía con Resonancia Magnética (CPRM) y estimulación hormonal
La Colangio – Pancreatografía con Resonancia Magnética (CPRM) con estimulación hormonal con secretina se ha propuesto como un nuevo método de valoración de la función pancreática. La secretina mejora las imágenes ya que permite evaluaciones secuenciales del relleno duodenal, así como valorar las variaciones del tamaño pancreático, proporcionando una estimación de la función pancreática exocrina. Es una técnica aún no validada y que necesita más estudios.
2.3.2 Pruebas orales
Miden el efecto de la secreción pancreática con una comida de prueba. Asociados a esa comida se emplean diversos marcadores que son hidrolizados por la acción de las enzimas pancreáticas y posteriormente, sus metabolitos son reabsorbidos, por lo que pueden medirse tanto en suero como en orina, tras eliminación renal. Los marcadores más empleados son ácido N-benzoyl-L-tyrosyl-p-aminobenzoico (prueba de NBT-PABA) y el dilaurato de fluoresceína (prueba del Pancreolauril). Este último es la principal prueba oral para valorar la IP, aunque en pediatría, su uso es excepcional.
Recomendaciones
En centros especializados que cuenten con una Unidad de Fibrosis Quística, para un buen diagnóstico y control de la insuficiencia pancreática, se debe disponer de la determinación de elastasa fecal, poder cuantificar la grasa en heces (FENIR), así como poder calibrar las encuestas nutricionales para determinar el CRG.
En aquellos centros en los que no se dispongan de estas medidas, el esteatocrito y el control estricto de la ganancia ponderal pueden servir como orientación diagnóstica, mientras se implementa la determinación de E1F.
Sería conveniente valorar la proyección de implementar en cada país, al menos un centro de referencia donde puedan ser enviadas las muestras, concentrando así su determinación.
Bibliografía
- Durie PR. Pancreatic aspects of cystic fibrosis and other inherited causes of pancreatic dysfunction. Med Clin North Am. 2000; 84(3):609-620.
- Zielenski J.Genotype and phenotype in cystic fibrosis. Respiration 2000; 67(2):117-133.
- Walkowiak J, Lisowska A, Blaszczyński M. The changing face of the exocrine pancreas in cystic fibrosis: pancreatic sufficiency, pancreatitis and genotype. Eur J Gastroenterol Hepatol. 2008; 20(3):157-160.
- Domínguez-Muñoz JE, Martinez SM, Leodolter A, Malfertheiner P Quantification of pancreatic zinc output as pancreatic function test: making the secretin-caerulein test applicable to clinical practice. 2004; 4(1):57-62.
- Tardelli AC, Camargos PA, Penna FJ, Sarkis PF, Guimarães EV.Comparison of diagnostic methods for pancreatic insufficiency in infants with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2013; 56(2):178-181.
- Baker RD. Assessing exocrine pancreatic function: when the best test is not possible. J Pediatr Gastroenterol Nutr. 2013; 56(2):116-117.
- Karl Nissler, Irene Von Katte, Angela Huebner, and Jobst Henke Pancreatic Elastase 1 in Feces of Preterm and Term Infants. J Pediatr Gastroenterol Nutr. 2001; 33(1):28-31.
- Borowitz D, Baker SS, Duffy L, Baker RD, Fitzpatrick L, Gyamfi J, Jarembek K. Use of fecal elastase-1 to classify pancreatic status in patients with cystic fibrosis. J Pediatr. 2004; 145(3):322-326.
- Ayling RM. New faecal tests in gastroenterology. Ann Clin Biochem. 2012; 49(1):44-54.
- Walkowiak J, Nousia-Arvanitakis S, Henker J, et al. Indirect pancreatic function testing in children. J Pediatr Gastrenterol Nutr 2005; 40(2): 107–114.
2. Tratamiento de reposición enzimática (TRE) en FQ
Coordinadora. Subtema: Mónica González (Chile)
Autores: Lidia Garcete (Paraguay), Lourdes Ortiz (Paraguay), Liliana Landino (Colombia), Mario Cesar Menchaca Marines (Mexico), Silvia Balbarrey (Argentina), Lucrecia Suárez Cortina (España)
Cuando la secreción de enzimas pancreáticos está disminuida o abolida se recurre a la administración exógena de preparados comerciales que contienen estas enzimas, en un intento de suplir el defecto y conseguir una hidrólisis intraluminal adecuada de las grasas, proteínas e hidratos de carbono.
Lo deseable es conseguir que en la segunda porción del duodeno haya una concentración de lipasa, amilasa y proteasa lo más parecida posible a las que se encuentran cuando la secreción pancreática es normal. De esta forma se consigue minimizar las pérdidas fecales de grasas y vitaminas liposolubles, mejorando la digestión y absorción.
Es fundamental conseguir una adecuada TRE, ya que la maldigestión y malabsorción tiene consecuencias sobre el estado nutricional y esto se correlaciona directamente con la función pulmonar y por tanto con la calidad de vida y la supervivencia (1) (2).
La liberación de las enzimas debe ser lenta y progresiva para dar tiempo a que se produzca una hidrólisis completa. Los preparados enzimáticos tienen una cubierta gastroprotectora que evita la inactivación de las enzimas a su paso por el medio ácido del estómago y por la acción proteolítica de las bacterias; son eficaces siempre que el pH del estómago se mantenga entre 4.0 y 5.0 (3).
Cuando se ingieren las enzimas, la cápsula de gelatina se disuelve en el estómago para liberar microesferas recubiertas de un polímero de celulosa estable en pH ácido, que se descompone en ambiente alcalino. Las microesferas permanecen intactas en el estómago, se mezclan con los alimentos ingeridos y al pasar al duodeno se activan y actúan favoreciendo la hidrólisis de los nutrientes, especialmente de las grasas. El pico de actividad ocurre a los 30 minutos tras la ingesta y la liberación termina aproximadamente 2 horas después.
Para evitar la maldigestión de los alimentos, la concentración de enzimas en el duodeno debe ser equivalente al 5 -10 % de la cantidad que normalmente está presente después de la máxima estimulación del páncreas teniendo en cuenta que la actividad de las enzimas varía en función del pH del medio.
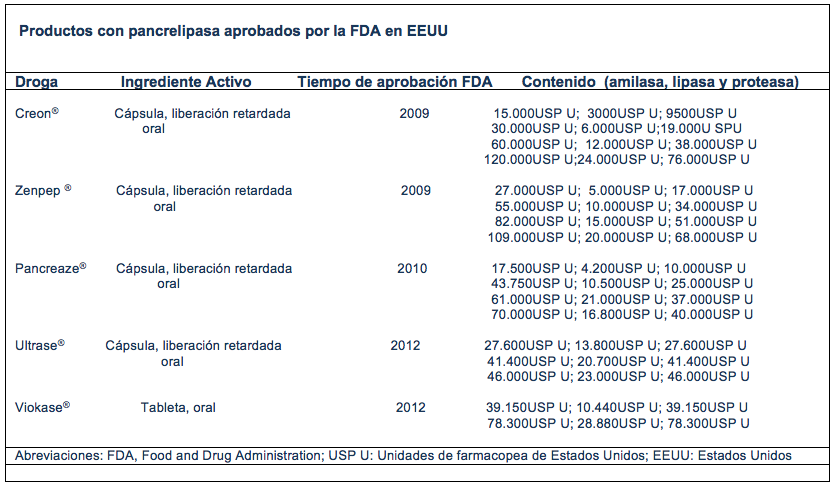
En el año 2010 la FDA estableció normas estrictas para la elaboración y fabricación de preparados enzimáticos, buscando productos más seguros, eficaces y bien tolerados, sugiriendo a las empresas farmacéuticas incentivar estudios multicéntricos, doble ciego, placebo-controlados, randomizados.
Los preparados comerciales aprobados por la FDA son: el Creon ® (pancreatina), el Pancreaze ® (pancreolipasa) y el Zenpep ® (pancreolipasa de liberación lenta).
2.1. Unidades de medida
Las unidades se refieren a la cantidad de enzima contenida en un miligramo de polvo.
Para hacer las comparaciones más fáciles la actividad de las enzimas se expresa generalmente como Unidades Internacionales (UI). Una UI se define como la cantidad de enzima requerida para liberar 1 mol de producto desde el sustrato utilizado por ml por minuto en las condiciones estándar de ensayo (4).
Las unidades de medida que se emplean son las de la farmacopea americana (U.S.P.), de la británica (U.B.P.), la europea (U.E.Ph.) y las de la Federación Internacional de Farmacia (F.I.P.).
Una unidad de actividad de lipasa es la cantidad de esta enzima capaz de liberar 1 microequivalente de ácido graso por minuto en un pH de 9.0 a 37ºC.
Las unidades de la farmacopea británica, europea y de la Federación Internacional son equivalentes. Una unidad de actividad de proteasa de la B.P. equivale a 62,5 unidades de la U.S.P., una unidad de lipasa de la B.P. equivale a una unidad de la U.S.P. y una unidad de amilasa de la B.P. equivale a 4,15 unidades de la U.S.P.
2.2 Preparados enzimáticos
Todos los preparados enzimáticos disponibles en el momento actual son de origen porcino, aunque hay en investigación enzimas biológicos.
2.2.1 CREON® (Abbott Products, GmbH, Hannover, Germany) (Pancreolipasa), USP (Creon®, Solvay Pharmaceuticals,Inc., Marietta, GA, USA)
– Disponible en formato de: 3.000, 6.000, 12.000, y 24.000 unidades de lipasa por cápsula recubierta con protección entérica.
– Contiene enzimas con acción lipolítica, amilolítica y proteolítica. Su máxima actividad se consigue en medio neutro o alcalino y pierde su capacidad en medio ácido, fuertemente alcalino o en una solución acuosa en ebullición. Debe almacenarse a una temperatura que no exceda los 15ºC en contenedores cerrados. Se puede diluir en lactosa o sacarosa. Los preparados en polvo pierden eficacia en el medio ácido del estómago, ya que a pH entre 1 y 5 las enzimas se inactivan en menos de 50 segundos.
Los preparados se presentan en forma de polvo, tabletas y comprimidos sin protección entérica y en cápsulas de liberación lenta con protección entérica. La eficacia de las enzimas que no son gastrorresistentes no se ha comparado directamente con los preparados recubiertos, pero los niños tratados con estos preparados cumplen el objetivo de lograr un crecimiento y una ganancia de peso adecuada (5).
Efectos adversos
La pancreatina puede producir inflamación y dolor en la boca y en la región perianal, especialmente en los niños. Si el preparado se retiene en la boca puede producir úlceras y estomatitis, por lo que es muy importante el lavado tras su administración (6). Se han descrito reacciones de hipersensibilidad con estornudos, lagrimeo, rash, crisis de broncoespasmo y ataques de asma. En ocasiones puede aparecer hiperuricosuria pero solo en relación con dosis elevadas (7).
2.2.2 PANCREAZE® (Nordmark Arzneimittel GmbH & Co. KG, Uetersen, Germany) (Pancreolipasa)
– Disponible en formato: 4.200, 10.500, 16.800 y 21.000 unidades por cápsula con cubierta de protección entérica.
– Contiene enzimas con acción proteolítica, amilolítica y lipolítica de la pancreolipasa que favorecen la digestión de proteínas, almidones y grasas en el duodeno y yeyuno proximal. Su actividad aumenta en un medio neutro o francamente alcalino. Dada su mayor concentración y pureza se recomienda su uso frente a la pancreatina, si se dispone de ambos.
Los preparados deben almacenarse en depósitos cerrados a una temperatura que no exceda los 25º C.
Las formas farmacéuticas habituales son las cápsulas, el polvo y los comprimidos. Los antiácidos que contienen carbonato de calcio o hidróxido de magnesio pueden disminuir la eficacia de la pancreolipasa. La absorción de hierro también puede verse disminuida cuando se usan simultáneamente hierro y pancreolipasa (8).
Efectos adversos
Entre los síntomas y signos atribuidos a la administración de pancreolipasa están la hematuria, artralgias, edema de pies o de la parte inferior de las piernas, diarrea, náuseas, calambres, dolor abdominal, irritación de la mucosa bucal, dificultad respiratoria, sibilancias, opresión torácica, congestión nasal, rash cutáneo y urticaria. Todas estas reacciones son posibles, pero muy infrecuentes (9).
2.2.3 ZENPEP® (Eurand S.p.A., Milan, Italy) (Pacreolipasa)
– Disponible en formato de: 5.000,10.000, 15.000 y 20.000 unidades de lipasa por cápsula recubierta con protección entérica (10).
2.2.4 ULTRASE® MT (Pancrelipase cápsulas) by: AXCAN PHARMA US, INC. 22 Inverness Center, Parkway, Birmingham.
– Dispone en capsulas de 12.000, 18.000 u 20.000 unidades de lipasa por capsula
2.2.5 Viokase® (Aptalis Pharma EE.UU., Inc)
– Disponible en capsulas, no gastroprotegidas, de 8.000, 16.000 y 16.800 unidades de lipasa, deben tomarse con un inhibidor de bomba de protones.
Existen otros preparados, como Ultrase® y Viokase®, también de liberación retardada, con difrentes presentaciones según las Unidades de lipasa.
3. Dosificación de los preparados enzimáticos
El Comité de Consenso de la Fundación Americana de Fibrosis Quística hace las siguientes recomendaciones (11) (12).
- Fórmula infantil o pecho: 2.000-4.000 U Lipasa/120 ml
- 12 meses-4 años comenzar con 1.000 U Lipasa/Kg/comida
- > de 4 años y adultos comenzar con 500 U Lipasa/Kg/comida
- Dosis máxima de 2.500 U Lipasa/Kg/comida o 10.000 U Lipasa/kg/día : NO SOBREPASAR
- Añadir la mitad de la dosis de cada comida con los aperitivos o snacks
Otra forma de dosificar: Unidades de lipasa por grasa ingerida
- Sólidos y líquidos: 500-4.000 U Lipasa/g de grasa ingerida
- Media de 1.800 U Lipasa/g de grasa ingerida dividido en dosis
- No pasar de > 4.000 U Lipasa x g de grasa ingerida
Los preparados deben administrarse al inicio y durante las comidas, según la duración de la comida. Si el paciente come despacio y tarda más de 40 minutos en comer, se debe fraccionar la administración dando la mitad al comienzo y el resto a la mitad de la alimentación.
No deben masticarse (se inactivan) ni permanecer en la boca (producen irritación). Las cápsulas pueden abrirse si el paciente no puede tragarlas y el contenido se debe mezclar en una pequeña porción de papilla o puré ácida, como compota de manzana que debe tomarse de inmediato de realizada la mezcla.
Se debe disminuir la dosis cuando las comidas tengan poco o nada de grasa, pero no suprimir del todo ya que los preparados contienen también amilasa y proteasas, necesarias para la absorción de otros macronutrientes.
En lactantes que no reciben lactancia materna, se pueden utilizar fórmulas semi-elementales durante los primeros 4 a 6 meses de vida, que aporten la grasa en forma de MCT. Esta opción se reserva solo para casos especiales en los que no se consiga una buena respuesta con el TRE.
En definitiva, los pacientes y sus familiares deben conocer cómo actúa el TRE para poder dosificar de forma adecuada la cantidad y el momento de la ingesta, ya que, al margen de las normas generales, con frecuencia es preciso hacer pequeñas modificaciones para conseguir el efecto más fisiológico posible.
4. Control y eficacia del tratamiento
La dosificación de enzimas se ajustará según la respuesta clínica y analítica, aumentando la dosis hasta los límites permitidos si se considera necesario.
Se debe valorar la desaparición del malestar y la distensión abdominal, la disminución del número y volumen de las deposiciones y la presencia o no de grasa en las mismas, además de la ganancia de peso y a más largo plazo el aumento de talla.
El control bioquímico de la efectividad del tratamiento se basa sobre todo en la cuantificación de grasas en heces y el crecimiento.
5. Respuesta inadecuada al TRE
Causas
– Mal cumplimiento de forma voluntaria o por desconocimiento. Es preciso prestar una atención especial a los pacientes adolescentes y a los que no quieren aumentar de peso
– Factores que influyen sobre la adecuada actividad enzimática (13) (14) (15):
- Inactivación por pH inadecuado
- Retraso en la liberación
- Deficiencia de Sales Biliares
- Inadecuada emulsión
- Escasa formación de micelas
- Moco intestinal espeso
- Sobredesarrollo bacteriano (disbiosis)
- Liberación de mediadores neurohormonales inhibitorios
- Preparados genéricos que no contienen cantidades adecuadas
- Infección por parásitos
- Enfermedades intercurrentes como: Enfermedad inflamatoria intestinal o Enfermedad celíaca
6. Efectos adversos del TRE
Hasta el momento no se han demostrado efectos adversos graves de ninguno de los preparados.
Efectos secundarios
- Locales
La retención de los preparados en la boca antes de ser deglutidos puede producir irritación y ulceración de la mucosa si permanecen mucho tiempo en contacto, con aparición de estomatitis y úlceras. Se recomienda mezclarlas con un poco de alimento al inicio de la comida o mezclarlas con este si no pueden ser deglutidas rápidamente (16).
- Generales
El exceso de dosificación de pancreatina o de pancreolipasa puede producir diarrea, dolor abdominal, náuseas, distensión abdominal, dolor de cabeza y mareos. En algunas personas se han detectado reacciones de hipersensibilidad con rash, lagrimeo, estornudos e incluso ataques de asma. También se han comunicado casos de asma por inhalación de productos en polvo y carencias de hierro en los sujetos a los que se les ha administrado de forma prolongada enzimas pancreáticas.
Desde hace dos décadas, se ha relacionado la aparición de colopatía fibrosante (estenosis intestinales a nivel del colon) con la ingesta de grandes dosis de preparados enzimáticos con alto contenido en lipasa. Aunque la asociación es clara, todavía no se conoce bien su base fisiopatológica y se ha visto que únicamente se desarrolla en pacientes que están recibiendo altas dosis de TRE. Se cree que puede estar relacionada con componentes de la cubierta entérica o a daño local producido por proteasas o actividad inmune local propia de la enfermedad.
Previamente se habían descrito hiperuricemias e hiperuricosurias en pacientes que estaban en tratamiento con pancreolipasa, pero posteriormente se ha demostrado que dicha asociación no existe (17).
7. Contraindicaciones
Los preparados enzimáticos están contraindicados en personas con hipersensibilidad a las proteínas del cerdo.
8. Enzimas pancreáticos en nutrición enteral a débito continuo
Algunos pacientes con FQ requieren alimentación enteral a través de sonda gástrica o gastrostomía, para completar su dieta con calorías adicionales y poder conseguir y mantener un adecuado estado nutricional. Dentro de este grupo pacientes, algunos son capaces de tomar la TRE por vía oral sin problemas, pero otros no.
Recomendaciones para la adecuada administración de enzimas pancreáticas a través de las sondas de alimentación enteral (18):
- Para sondas nasogástricas o gastrostomías se recomienda la abrir las cápsulas y mezclar las microesferas en un preparado ácido espesado tipo compota de manzana, que se introduce a través de la sonda cada 2 a 4 horas. De esta manera se minimiza la aglutinación y precipitación del producto en la sonda y por lo tanto la obstrucción de la misma.
- En los casos en los que las sondas sean nasoyeyunales o yeyunales, las microesferas con las enzimas se pueden triturar y añadir bicarbonato sódico activado (de 5 a5 ml de bicarbonato de sodio al 8.4% durante 15 a 20 minutos) antes de pasarlo por la sonda o bien administrarlo junto con la alimentación
Estos métodos resultan difíciles de aplicar por lo que en la práctica se puede utilizar fórmulas semielementales con MCT que no necesitan la terapia de reemplazo enzimático cuando se administran en forma continua.
Bibliografía
- Wier HA, Kuhn RJ.Pancreatic enzyme supplementation. Curr Opin Pediatr. 2011 Oct;23 (5):541-4.
- Taylor JR, Gardner TB, Waljee AK, et al. A Stematic review: efficacy and safety of pancreatic enzyme supplements for exocrine pancreatic insufficiency. Aliment Pharmacol Ther. 2010 Jan;31 (1):57-72.
- Guidance for Industry Exocrine Pancreatic Insufficiency Drug Products – Submitting NDAs U.S. Department of Health and Human Services Food and Drug Administration.Center for Drug Evaluation and Research (CDER) April 2006. Clinical/Medical. http://www.fda.gov/cder/guidance/index.htm
- Fieker A, Philpott J, Armand M. Enzyme replacement therapy for pancreatic insufficiency: present and future. Clin Exp Gastroenterol. 2011;4:55-73.
- Ellis L, Kalnins D, Corey M, et al. Do infants with cystic fibrosis need a protein hydrolysate formula? A prospective, randomized, comparative study. J Pediatr. 1998;132(2):270–276.
- Kalnins D, Wilschanski M. Maintenance of nutritional status in patients with cystic fibrosis: new and emerging therapies.Drug Des Devel Ther.2012;6:151-61.
- Trapnell BC, Maguiness K, Graff GR, et al. Efficacy and safety of Creon 24,000 in subjects with exocrine pancreatic insufficiency due to cystic fibrosis. J Cyst Fibros. 2009 Dec;8 (6):370-7.
- Trapnell BC, Strausbaugh SD, Woo MS, et al. Efficacy and safety of PANCREAZE® for treatment of exocrine pancreatic insufficiency due to cystic fibrosis. J Cyst Fibros. 2011 Sep;10 (5):350-6.
- Nakajima K, Oshida H, Muneyuki T,et al. Pancrelipase: an evidence-based review of its use for treating pancreatic exocrine insufficiency. Core Evid. 2012; 7:77-91.
- Wooldridge JL, Heubi JE, Amaro-Galvez R, et al. EUR-1008 pancreatic enzyme replacement is safe and effective in patients with cystic fibrosis and pancreatic insufficiency. J Cyst Fibros. 2009 Dec; 8(6):405-17.
- Borowitz DS, Grand RJ, Durie PR. Use of pancreatic enzyme supplements for patients with cystic fibrosis in the context of fibrosing colonopathy. Consensus Committee. J Pediatr. 1995; 127(5):681-684.
- Stallings VA, Stark LJ, Robinson KA, et al. Clinical Practice Guidelines on Growth and Nutrition Subcommittee; Ad Hoc Working Group. Evidence-based practice recommendations for nutrition-related management of children and adults with cystic fibrosis and pancreatic insufficiency: results of a systematic review.J Am Diet Assoc. 2008 May;108(5):832-9.
- Food and Drug Administration. Exocrine Pancreatic Insufficiency Drug Products (Notice). Federal Register [notice]. 2004; 69:23410-4.
- Food and Drug Administration. Exocrine Pancreatic Insufficiency Drug Products: Extension to Obtain Marketing Approval (Notice). Federal Register 2007; 72:60860-2.
- Fieker A, Philpott J, Armand M.Enzyme replacement therapy for pancreatic insufficiency: present and future. Clin Exp Gastroenterol. 2011; 4: 55-73.
- Snead E.Oral ulceration and bleeding associated with pancreatic enzyme supplementation in a German shepherd with pancreatic acinar atrophy. Can Vet J. 2006 Jun; 47(6):579-82.
- Stern RC, Eisenberg JD, Wagener JS, et al. A comparison of the efficacy and tolerance of pancrelipase and placebo in the treatment of steatorrhea in cystic fibrosis patients with clinical exocrine pancreatic insufficiency. Am J Gastroenterol. 2000; 95(8):1932-1938.
- Suzie Ferrie, Christie Graham and Matthew Hoyle. Pancreatic Enzyme Supplementation for Patients Receiving Enteral Feeds. Nutr Clin Pract 2011 26: 349.